Frâncio- Um Metal Altamente Radioativo
Este elemento é o segundo elemento menos abundante na natureza (o primeiro é o astato).
O frâncio é um metal alcalino altamente radioativo. Como todos os metais alcalinos, tem um eletrão de valência.
 Marguerite Perey descobriu este elemento em 1939. O frâncio foi o último elemento químico descoberto na natureza antes de ser sintetizado. Fora do laboratório, o frâncio é extremamente raro.
Marguerite Perey descobriu este elemento em 1939. O frâncio foi o último elemento químico descoberto na natureza antes de ser sintetizado. Fora do laboratório, o frâncio é extremamente raro.Natureza
Existem traços de frâncio nos minerais de urânio.
O Frâncio também se pode sintetizar. Frâncio
Existem 41 isótopos de frâncio conhecidos. Com uma meia-vida de 22 minutos, o isótopo Fr-223 é o de mais longa vida deste elemento. Todos os demais são altamente instáveis, consequentemente , o conhecimento das propriedades deste elemento não podem ser obtidos por procedimentos radioquímicos.
Grupo Dos Halogéneos
O grupo 17 é o grupo dos halógeneos.
Os elementos químicos que fazem parte dele são: o Fluor (F), o Cloro (Cl), o Bromo (Br), o Iodo (I) e o Ástato (At).
 Os halogéneos têm todos 7 eletrões de valência e são mononegativos.
Os halogéneos têm todos 7 eletrões de valência e são mononegativos.
Estas substâncias têm caracteristicas semelhantes:
- dissolvem-se melhor em solventes orgânicos do que em água
- são substâncias muito reativas
- são constituidas por moléculas diatómicas, que mostra que os átomos dos halogéneos têm tendência a ligar-se
- O dicloro e o dibromo, por exemplo, reagem com os metais alcalinos e alcalino-terrosos, dando origem a sais chamados halogenetos.
Cloro + Sódio formam cloreto de sódio.
Iodo + Sódio formam iodeto de sódio.
Como é a reatividade dos halogéneos?
A facilidade do halogéneos em formar iões mononegativos é tanto maior quanto mais pequenos forem.
Os átomos de flúor, os mais pequenos, captam mais facilmente um eletrão, por isso, o flúor é o halogéneo mais reativo.
Os átomos de Ástato são maiores, por isso captam um ião com mais dificuldade, sendo menos reativos.
Os elementos químicos que fazem parte dele são: o Fluor (F), o Cloro (Cl), o Bromo (Br), o Iodo (I) e o Ástato (At).
 Os halogéneos têm todos 7 eletrões de valência e são mononegativos.
Os halogéneos têm todos 7 eletrões de valência e são mononegativos.Estas substâncias têm caracteristicas semelhantes:
- dissolvem-se melhor em solventes orgânicos do que em água
- são substâncias muito reativas
- são constituidas por moléculas diatómicas, que mostra que os átomos dos halogéneos têm tendência a ligar-se
- O dicloro e o dibromo, por exemplo, reagem com os metais alcalinos e alcalino-terrosos, dando origem a sais chamados halogenetos.
Cloro + Sódio formam cloreto de sódio.
Iodo + Sódio formam iodeto de sódio.
Como é a reatividade dos halogéneos?
A facilidade do halogéneos em formar iões mononegativos é tanto maior quanto mais pequenos forem.
Os átomos de flúor, os mais pequenos, captam mais facilmente um eletrão, por isso, o flúor é o halogéneo mais reativo.
Os átomos de Ástato são maiores, por isso captam um ião com mais dificuldade, sendo menos reativos.
Reação do sódio com água
Metais alcalino-terrosos
Os metais alcalino-terrosos fazem parte do 2º grupo da tabela períodica.
O metais alcalino-terrosos são: o Berílio (Be), o Magnésio (Mg), o Cálcio (Ca), o Estrôncio (Sr), o Bário (Ba) e o Rádio (Ra).
 Os metais alcalino-terrosos são:
Os metais alcalino-terrosos são:
- bons condutores de calor e eletricidade
- são moles e maleáveis
- têm brilho metálico quando recentemente polidos
- têm propriedades químicas semelhantes. Reagem com a água um pouco mais lentamente que os metais alcalinos e também formam soluções básicas
Os metais alcalino-terrosos com a água formam hidróxido do metal e di-hidrogénio. Na combustão do metal forma-se o óxido do metal.
Os metais alcalinos formam iões dipositivos, por isso os seus hidróxidos vão ser, por exemplo: Mg(OH)2, pois o hidróxido é mononegativo.
Quanto maiores forem os átomos, mais reativos vão ser. Os metais alcalino-terrosos são menos reativos que os alcalinos porque é mais difícil perder 2 eletrões do que perder 1 eletrão.
O metais alcalino-terrosos são: o Berílio (Be), o Magnésio (Mg), o Cálcio (Ca), o Estrôncio (Sr), o Bário (Ba) e o Rádio (Ra).
 Os metais alcalino-terrosos são:
Os metais alcalino-terrosos são:- bons condutores de calor e eletricidade
- são moles e maleáveis
- têm brilho metálico quando recentemente polidos
- têm propriedades químicas semelhantes. Reagem com a água um pouco mais lentamente que os metais alcalinos e também formam soluções básicas
Os metais alcalino-terrosos com a água formam hidróxido do metal e di-hidrogénio. Na combustão do metal forma-se o óxido do metal.
Os metais alcalinos formam iões dipositivos, por isso os seus hidróxidos vão ser, por exemplo: Mg(OH)2, pois o hidróxido é mononegativo.
Quanto maiores forem os átomos, mais reativos vão ser. Os metais alcalino-terrosos são menos reativos que os alcalinos porque é mais difícil perder 2 eletrões do que perder 1 eletrão.
Os Metais Alcalinos
Os metais que estão no grupo 1 da tabela períodica denominam-se de metais alcalinos.
Os metais alcalinos são: O Lítio (Li), o Sódio (Na), o Potássio (K), o Rubídio (Rb), o Césio (Cs) e o Frâncio (Fr).
Estes metais alcalinos são:

- bons condutores elétricos
- moles e maleáveis
- têm brilho metálico quando recentemente cortados na superfície
- têm propriedades químicas semelhantes
Os metais alcalinos são: O Lítio (Li), o Sódio (Na), o Potássio (K), o Rubídio (Rb), o Césio (Cs) e o Frâncio (Fr).
Estes metais alcalinos são:

- bons condutores elétricos
- moles e maleáveis
- têm brilho metálico quando recentemente cortados na superfície
- têm propriedades químicas semelhantes
A semelhança de comportamento dos metais alcalinos:
Da reação dos metais alcalinos com a água, resultam os respetivos hidróxidos. As soluções dos hidróxidos são básicas ou alcalinas, por isso a fenolftaleína torna-se carmim. Para além do hidróxido do metal, também se forma dihidrogénio, responsável pelo ruído que se ouve durante a reação química.
Quanto maiores são os átomos dos metais alcalinos, mais facilmente perdem o eletrão de valência (são todos monopositivos). O tamanho dos átomos dos elementos de um grupo da tabela períodica vai aumentando ao longo do grupo, por isso, quanto o lítio é o elemento mais pequeno, por isso o menos reativo e o frâncio vai ser o mais reativo.
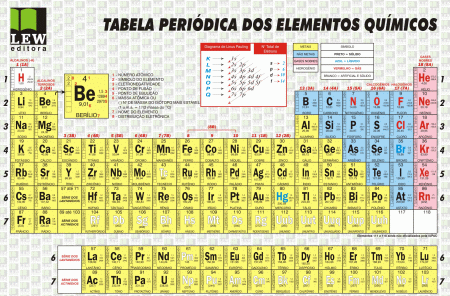
Tabela Periódica dos Elementos Químicos
O que é um Elemento Químico?
Um Elemento Químico é um conjunto formado por átomos que têm o mesmo número de protões no seu núcleo, isto é, o mesmo número atômico (Z). Cada elemento é reconhecido por um símbolo. O ouro, por exemplo, tem símbolo (Au) e o Lítio (Li)
A Tabela Periódica traz uma enorme quantidade de elementos químicos. A maioria dos elementos são encontrados na natureza e são conhecidos como elementos naturais. Alguns elementos cujos átomos são criados artificialmente, em laboratórios, são chamados de elementos sintéticos.
Todos os elementos químicos possuem número atómico e nº de massa. No total de 118 elementos, mais de 80 deles são elementos naturais e o restante são produzidos de forma artificial. Os elementos são distribuídos na Tabela Periódica, seguindo em ordem crescente pelos seus números atómicos e de acordo com a semelhança de suas propriedades.
A Tabela Periódica dos Elementos Químicos atual possui filas horizontais e cada uma delas representa um período. A Tabela Periódica tem 7 períodos, eles correspondem á quantidade de níveis de energia utilizados pelos eletrões, ex: 1ºperíodo-1 nível de energia utilizado, 2º período, 2 níveis de energia utilizados.
Para além dos períodos, a tabela períodica também tem colunas, os grupos. Existem 18 grupos,os elementos do mesmo grupo têm propriedades químicas semelhantes, e, no geral, o mesmo nº de eletrões de valência.
Os do grupo 2 são os metais alcalino-terrosos
Do grupo 3 ao 12 são os metais de transição
Do grupo 17 são os Halogéneos
Do grupo 18 são os Gases Nobres
A Evolução do Modelo Atómico
Nem sempre se conheceu o átomo como se conhece atualmente. Foi uma ideia que evoluiu ao longo dos anos.
Apesar do primeiro modelo atómico ter sido apresentado no séc. XIX, a ideia de que a matéria é feita de pequeníssimos corpúsculos surgiu há muito, muito tempo.
Modelo atómico de Dalton
John Dalton, retomou a ideia dos átomos como constituintes básicos da matéria. Para ele os átomos seriam partículas pequenas, indivisíveis e indestrutíveis.
Cada elemento químico seria constituído por um tipo de átomos iguais entre si. Quando combinados, os átomos dos vários elementos formariam compostos novos.
Assim, na sequência dos seus trabalhos, concluiu que:
- Os átomos que pertencem a elementos químicos diferentes, apresentam massas
diferentes, assim como propriedades químicas diferentes.
- Os compostos são associações de átomos de elementos químicos diferentes.
- As reações químicas podem ser explicadas com base no rearranjo dos átomos.
Modelo atómico de Thomson
Em 1897, Thomson descobriu partículas negativas muito mais pequenas que os átomos, os eletrões, provando assim que os átomos não eram indivisíveis.
Formulou a teoria de que os átomos seriam uma esfera com carga elétrica positiva onde estariam dispersos os eletrões suficientes para que a carga total do átomo fosse nula.
Modelo atómico de Rutherford
Mais tarde Rutherford demonstrou que a maior parte do átomo era espaço vazio, estando a carga positiva localizada no núcleo, tendo este a maior parte da massa do átomo. Os eletrões estariam a girar em torno do núcleo.
Rutherford também descobriu a existência dos protões, as partículas com carga positiva que se encontram no núcleo.
Este Modelo não explicava porque é que os eletrões não caem no núcleo, devido à atração que apresentam pelas cargas positivas aí existentes.
Modelo atómico de Bohr
Bohr apresentou alterações ao modelo de Rutherford: os eletrões só podem ocupar níveis de energia bem definidos, e os eletrões giram em torno do núcleo em órbitas com energia diferentes.
As órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior.
Os eletrões tendem a ter a menor energia possível - estado fundamental do átomo.
Modelo da Nuvem Eletrónica
No núcleo (centro) do átomo, estão os protões e os neutrões, enquanto que os eletrões giram em seu redor.
Os eletrões de um átomo ocupam determinados níveis de energia (o número de eletrões em cada nível de energia é expresso pela distribuição eletrónica).
Modelo de Rutherford

Modelo de Bohr
Modelo da Nuvem eletrónica

Subscrever:
Comentários (Atom)